电压门控钠(Nav)通道,作为一种关键的跨膜蛋白,在心脏、肌肉和神经等可兴奋组织中扮演着至关重要的角色,它们不仅参与动作电位的启动和传播,还与多种疾病的发生密切相关,其突变或功能异常往往导致如癫痫、疼痛、肌强直和心律失常等疾病。正因如此,Nav通道也成为了药物开发中的一个重要靶点。深入研究Nav通道的结构与功能,不仅有助于我们揭示其在生理和病理过程中的作用机制,而且在新药研发领域具有不可估量的价值。
2024年12月,湖南师范大学周熙课题组在美国生物化学和分子生物学学会旗下期刊《生物化学杂志》(Journal of Biological Chemistry,JBC)在线发表了题为“Multiple gating processes associated with the distal end of S6 segment of Domain II in the Nav channels”的研究论文。课题组长期从事钠通道与多肽毒素结构功能研究以及靶向药物研发工作(Adv Sci, 2024; Nat Commun, 2020等)。本研究中,研究人员在前期工作的基础上,利用膜片钳记录技术,系统阐述了Nav1.9的L811位点突变体(位于DII S6远端)和Nav1.4对应的L796P突变体的生物物理特性,揭示了Nav通道的DII S6远端偶联多个门控过程。
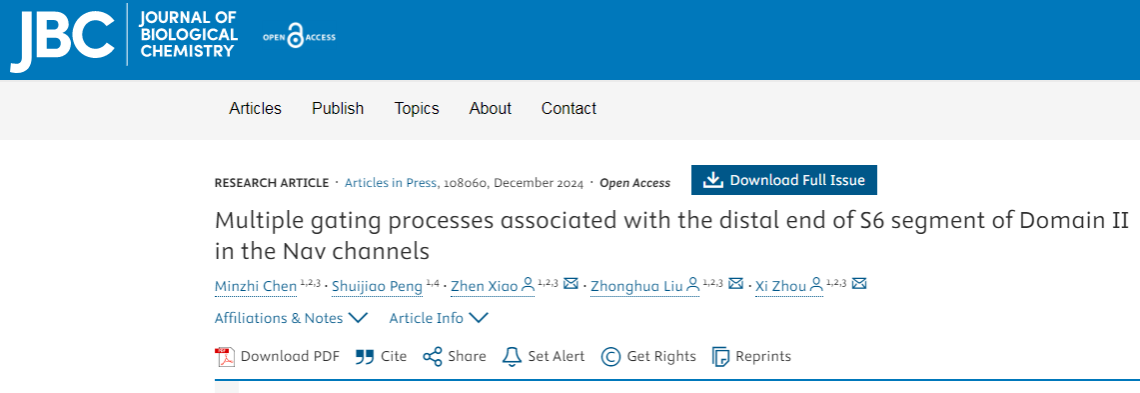
Nav通道由一个形成孔道的α亚基和一个或两个辅助β亚基组成。α亚基是一个单一的多肽链,由四个同源域(DI-DIV)围绕一个中心离子传导孔排列而成,每个域都有一个电压感受域(S1-S4)和一个孔道形成域(S5-S6)。四个同源域中S6的构象变化控制着通道孔的开启和关闭,并在Nav通道的门控过程中发挥着至关重要的作用。特别是,Nav通道的四个同源域的S6远端含多个疏水性残基,共同构成了一个内部门,与通道的激活和失活等相关。然而,对于DII S6远端偶联的门控机制,仍知之甚少。
1. DII S6段的远端影响Nav通道的激活
研究人员从Nav1.9的一个临床突变获得线索,Nav1.9 L811P是一个先前报道的特定新生错义突变,导致先天性疼痛不敏感。突变位点位于DII的S6远端,靠近细胞内区域,并且在所有哺乳动物Nav通道亚型中都是保守的。L811P突变显著将激活和去激活动力学向左移动,并且也减慢了快速失活。这些结果表明,DII S6中的L811参与了Nav1.9通道的激活和失活门控。因此,该突变位点可能是研究DII S6远端门控特征的一个关键切入点。于是,研究人员构建了多个突变体,以确定L811位点是否参与通道的多重门控过程。结果显示,这些突变体显著使通道的激活曲线向超极化飘移,有利于通道的开放,降低了激活能量障碍。在Nav1.4通道种,也得到相似的结果。综合这些结果表明,Nav通道DII S6的远端影响激活门控。
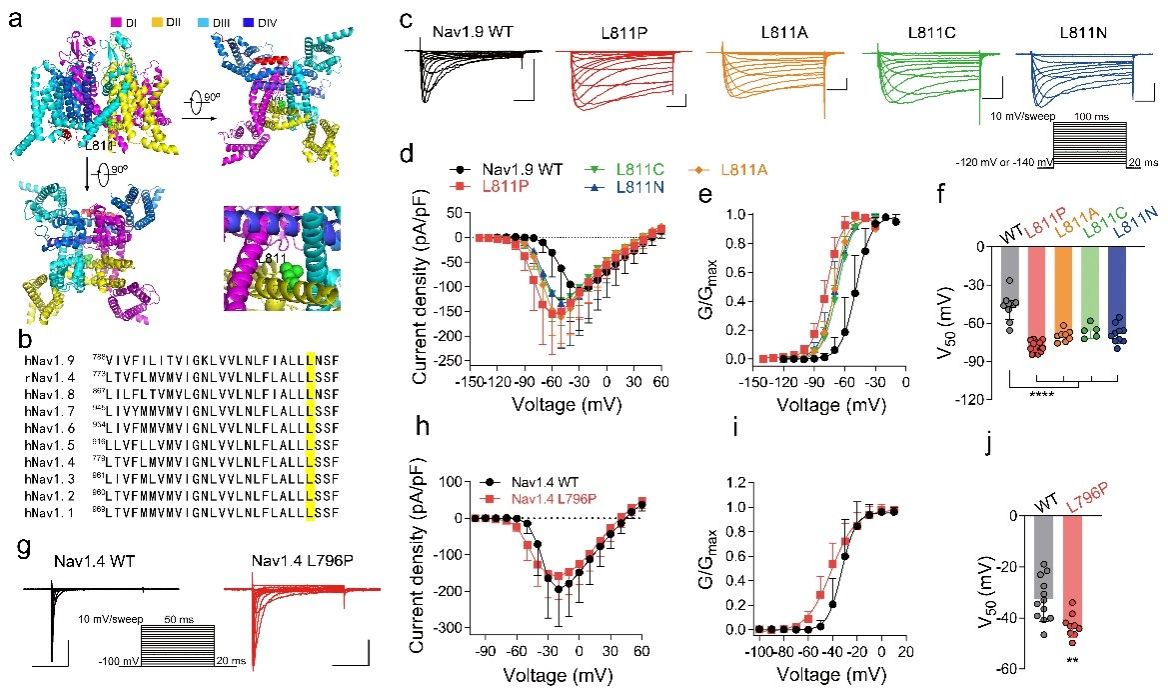
图1:Nav通道DII S6远端的Leu位点突变影响通道激活
2. DII S6段的远端也影响Nav通道的快速失活
快速失活是Nav通道的一个重要门控特性,与野生型(WT)通道相比,L811突变体显著减慢了通道的快速失活。与野生型(WT)通道相比,L811突变体显著减慢了通道的快速失活。我们发现所有四种L811突变体产生了非常大的持续电流。进一步研究发现,Nav1.9的L811位点参与了通道的快速失活过程,在Nav1.4 L796P通道中也观察到了相同的结果。
Nav通道的快速失活是由于位于DIII和DIV的细胞内连接域中的“失活球”,即IFMT基序,与其受体位点结合,通过变构而导致孔关闭。于是,研究人员探讨了L811突变是否影响IFMT基序与其受体位点的结合而延缓快失活。他们合成了KIFMK肽(一种模拟IFMT基序与受体位点结合的自由肽),并确定了其对Nav电流的抑制作用。当加入到细胞内溶液中时,KIFMK肽以浓度依赖性的方式抑制Nav1.9 WT和L811A的电流,但相比较,KIFMK对L811A电流的抑制程度显著弱于对WT的影响。这些结果表明,L811A突变可能影响了IFMT基序结合位点的构象,而降低了IFMT基序与其受体位点的结合的亲和力。
图2:L811突变导致IFMT基序与受体位点结合不稳定而影响通道快失活
3. L811P促进了慢速失活
Nav通道的慢速失活是一个重要的生物物理过程,它控制着通道在长时间去极化过程中的可再次开放的能力,并在神经元过度兴奋期间充当刹车。Nav通道的慢速失活可能涉及孔域的重新排列。L811突变导致通道显著向超极化方向飘移,使通道更容易进入慢失活状态,且加速通道进入慢失活以及不能完全从慢失活恢复,从而降低通道的可用性。综合这些结果表明,DII S6段远端L811位点可能在Nav通道的慢速失活中发挥关键作用。
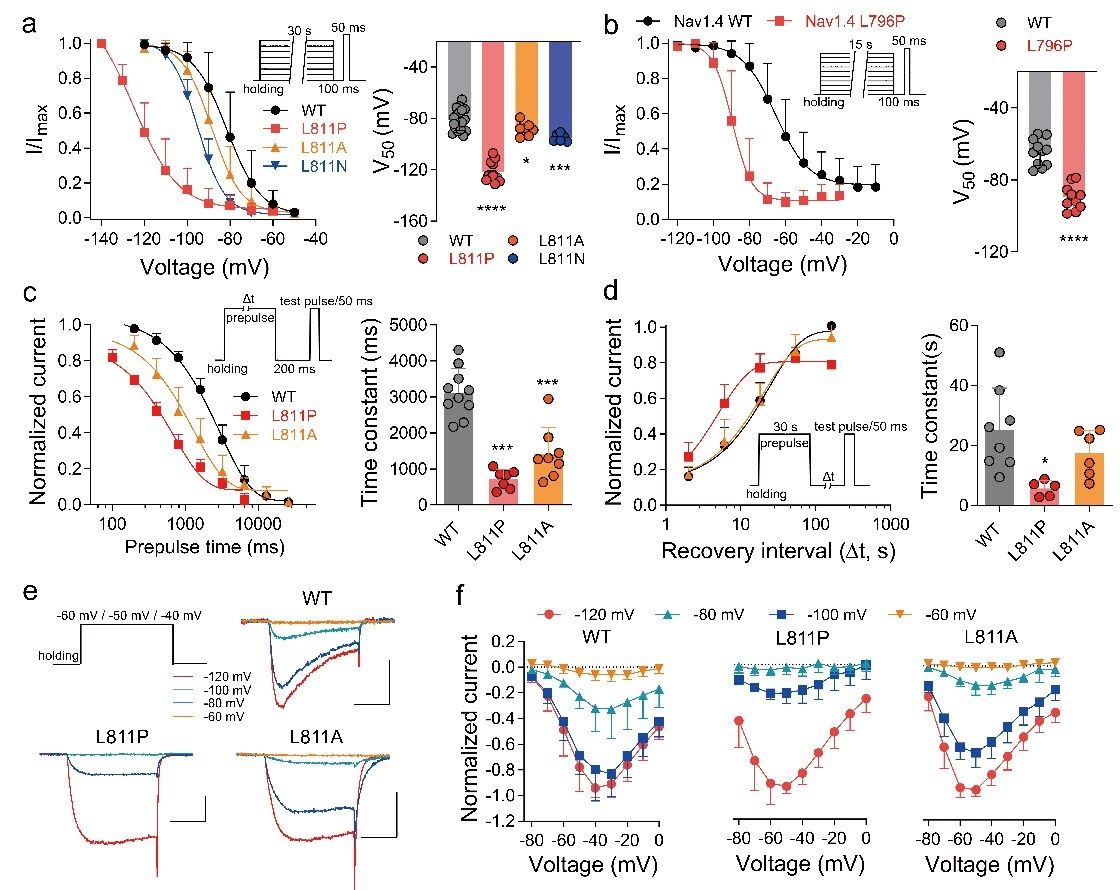
图3:L811P对通道慢失活的影响
4. DII S6段的远端影响Nav通道的使用依赖性失活
随后,研究人员探讨突变对通道使用依赖性失活的影响。结果发现突变后导致通道在高频下随着刺激脉冲的增加,快速进入失活状态而不能被再次开放,这结果突变体对慢速失活的影响一致,突变加速了进入慢速失活的过程,导致更大的使用依赖性失活。
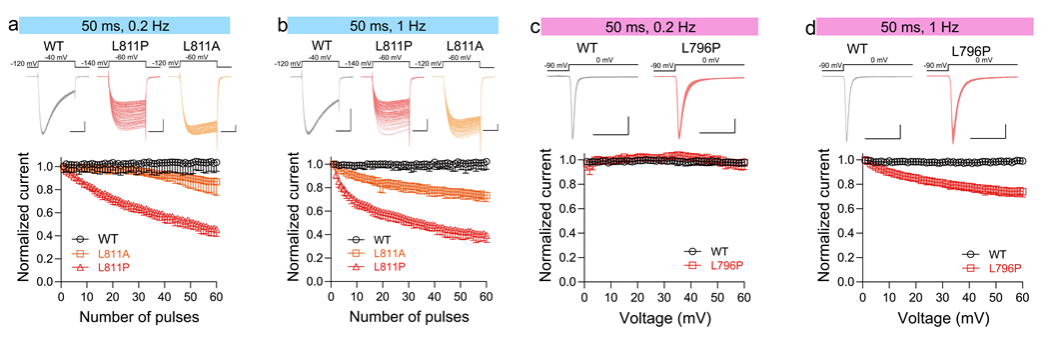
图4:Nav通道DII S6远端的Leu位点突变促进通道的使用依赖失活
5. L811P突变体改变了通道的离子选择性
L811突变导致通道的反转电位向超极化飘移了约5 mV,这可能是由离子选择性变化引起的。先前也有报道,Nav1.7的一个缺失突变(Del-L955,对应于Nav1.9中的L809位点)使反转电位移动了大约-7 mV,并且他们进一步揭示了Del-L955突变增加了对Cs+和Ca2+的通透性。因此,研究人员进一步探讨L811P突变体是否也改变了离子选择性。结果显示,L811P突变增加了IK/INa比率,但并未改变其对K+的渗透率。当细胞外液中的NaCl替换为CsCl时,从L811P通道观察到了微小的内向电流,而WT通道没有检测到内向电流。L811P通道的PCs/PNa比率为0.03 ± 0.01,由此可见,L811P突变通过增强通道对Cs+的通透性。
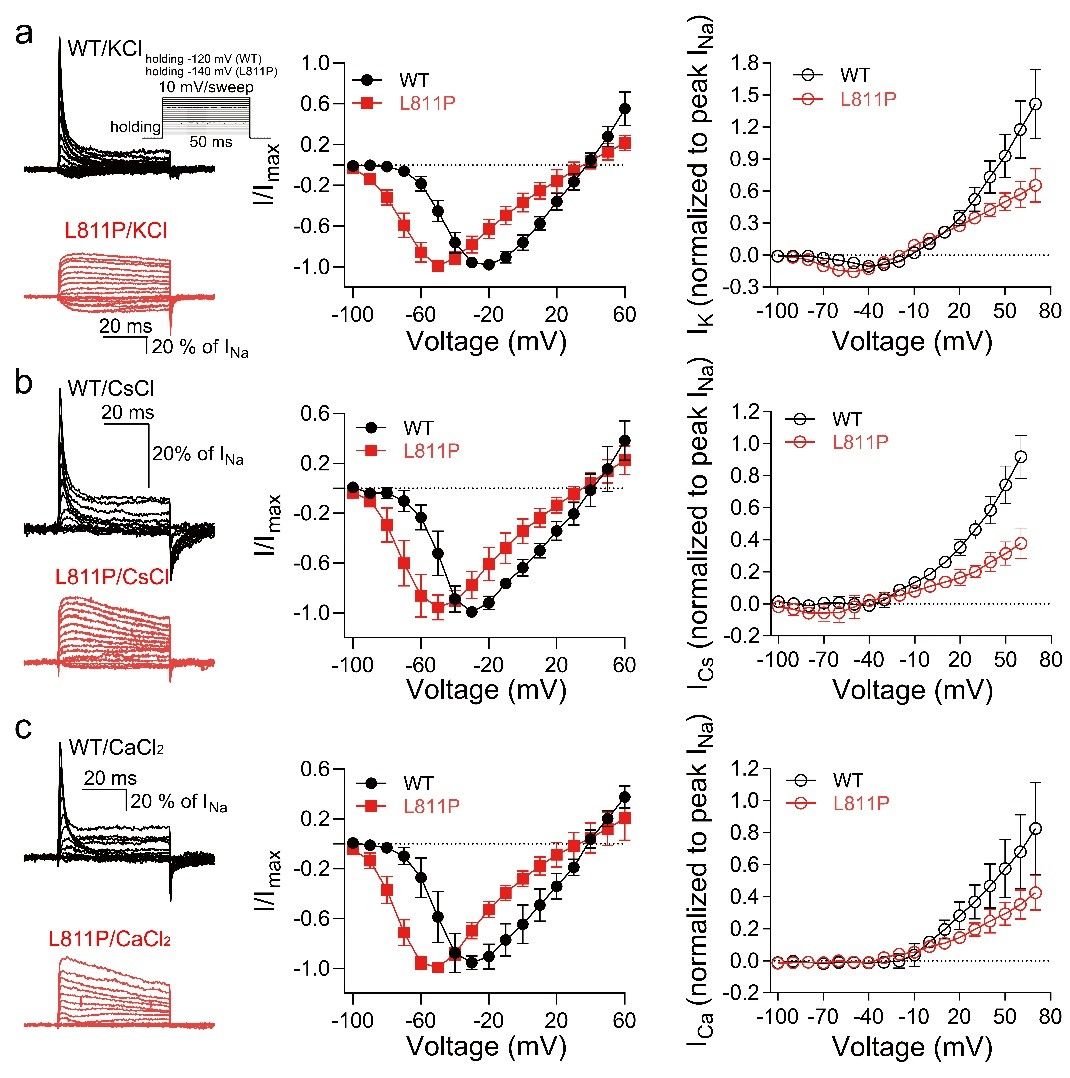
图5:L811P影响通道的离子选择性
综上所述,该研究揭示了Nav通道DII S6远端偶联多个门控过程,包括激活、快速失活和慢速失活等门控,以及影响选择性滤器的构象变化。这一发现不仅深化了我们对Nav通道复杂门控机制的认识,也为解析相关疾病的基因突变提供了分子层面的机制,更为靶向调控Nav通道功能的药物开发提供线索。
湖南师范大学周熙副教授是该论文的最后通讯作者,刘中华教授、肖震博士为本文的共同通讯作者。博士研究生陈敏芝为本文的第一作者。本研究得到了国家自然科学基金面上/青年基金、湖南省科技厅科技创新人才项目、芙蓉实验室科技攻关项目、湖南师大交叉学科经费等项目支持。
原文链接:DOI: 10.1016/j.jbc.2024.108060
